تعادل میکروبی درون ما_نقش پروبیوتیک ها و دیس بیوز در سلامت و بیماری


مقدمه – ارکستر میکروبی درون ما
ممکن است برایتان شگفت انگیز باشد که بدن انسان تقریباً به همان اندازه که سلول های انسانی دارد، میزبان باکتری ها نیز هست؛ حدود ۳۹ تریلیون باکتری در برابر ۳۰ تریلیون سلول انسانی، بر اساس برآوردهای بازنگری شده در منابع علمی. این میکروب ها مسافران بی اثر نیستند؛ بلکه یک اکوسیستم پویا و نامرئی را تشکیل میدهند که بر گوارش، ایمنی، متابولیسم و حتی خلق و خو تأثیر میگذارد.
این جامعه میکروبی که با عنوان «میکروبیوتای انسانی» شناخته میشود، امروزه تا حد زیادی به عنوان یک اندام عملکردی مستقل در نظر گرفته میشود. این مجموعه میتواند مواد مغذی ضروری مثل ویتامین K2 تولید کند، در برابر عوامل بیماری زا نقش دفاعی داشته باشد و از طریق محور روده–مغز با سیستم عصبی ارتباط برقرار کند؛ مسیری که احتمالاً بر شرایط روان شناختی مانند اضطراب و افسردگی اثر میگذارد.
اما هنگامی که این تعادل ظریف برهم بخورد چه اتفاقی رخ میدهد؟
«دیس بیوز» یا عدم تعادل میکروبی میتواند زنجیرهای از پیامدهای نامطلوب را در سیستم های مختلف بدن ایجاد کند؛ از بیماری های التهابی روده و سندرم متابولیک گرفته تا اختلالات آلرژیک و علائم نوروسایکیاتریک. در همین حال، افزایش علاقه به پروبیوتیک ها (میکروارگانیسم های زنده با پتانسیل اثرات سودمند) موجی از امید و البته بحث و تردید ایجاد کرده است.
- آیا واقعاً میتوانیم میکروبیوتای خود را برای پیشگیری یا درمان بیماری ها بازآرایی کنیم؟
- شواهد علمی چه می گویند؟
- و چگونه باید در میان وعده ها و چالش های این حوزه نوظهور حرکت کنیم؟
این مقاله روایت دوگانه پروبیوتیک ها و دیس بیوز را بررسی میکند: مکانیزم ها، اثرات سیستمیک، و نقش آن ها در یک رویکرد بالینی منطقی و مبتنی بر شواهد. اما پیش از ورود به این مباحث، لازم است چشم انداز کلی اکوسیستم میکروبی درون خود را بهتر درک کنیم.
اکوسیستم های میکروبی در سراسر بدن
اگرچه میکروبیوتای روده معمولاً بیشترین توجه را به خود جلب میکند، اما تنها بخشی از یک شبکه گسترده میکروبی است که سراسر بدن انسان را در بر میگیرد. از حفره های مرطوب دهان تا پوشش ظریف واژن، هر ناحیه آناتومیک میزبان جامعه ای خاص از میکروارگانیسم هاست؛ جامعه ای که با شرایط محلی سازگار شده، تحت تأثیر عوامل میزبان شکل میگیرد و با سلامت و بیماری پیوندی عمیق دارد.
این میکروبیوتاهای ناحیه ای موجوداتی منفعل نیستند. فلور دهانی از طریق مسیرهای مرتبط با بیماری های لثه، بر التهاب سیستمیک و حتی خطر بیماری های قلبی-عروقی تأثیر میگذارد. میکروبیوتای واژن که عمدتاً توسط گونه های لاکتوباسیلوس غالب است، نقش حیاتی در محافظت در برابر عفونت ها، حفظ تعادل pH و حمایت از سلامت تولیدمثل دارد. حتی پوست و ریه ها نیز دارای جمعیت های میکروبی هستند که در دفاع ایمنی و حفظ یکپارچگی سدهای حفاظتی نقش آفرینی میکنند.
نکته شگفت انگیز این است که این اکوسیستم ها از یکدیگر مجزا عمل نمیکنند. آنها از طریق سیگنال های ایمنی، متابولیت ها و حتی مهاجرت میکروبی با یکدیگر تعامل دارند. دیس بیوز در یک ناحیه (مثلاً روده) میتواند بازتابی از عدم تعادل در نقاط دیگر باشد یا حتی آن را تشدید کند. این درهم تنیدگی یادآور این واقعیت است که سلامت میکروبی مفهومی سیستمیک است، نه صرفاً موضعی.
در ادامه و هنگام بررسی عمیق تر میکروبیوتای روده و پیامدهای بالینی آن، باید به یاد داشت: بدن انسان یک «ابَرارگانیسم» است و ساکنان میکروبی آن، شریکانی اساسی در حفظ تعادل به شمار میروند.
میکروبیوتا به عنوان یک اندام عملکردی
برای دهه ها، میکروبیوتای انسانی به عنوان مجموعه ای منفعل از موجودات هم زیست در نظر گرفته میشد؛ موجوداتی که وجودشان پذیرفته شده بود اما اهمیتی برای آنها قائل نبودند. امروزه این دیدگاه به طور اساسی تغییر کرده است. میکروبیوتای روده اکنون یک اندام فعال متابولیک در نظر گرفته میشود که توانایی تأثیرگذاری بر فیزیولوژی، ایمنی و حتی رفتار میزبان را دارد.
ترکیب و پیچیدگی
میکروبیوتای روده از تریلیون ها میکروارگانیسم تشکیل شده است؛ از جمله باکتری ها، ویروس ها، قارچ ها و آرکی ها. این میکروب ها به صدها گونه تعلق دارند و گروه های عمده ای مانند Firmicutes، Bacteroidetes، Actinobacteria و Proteobacteria را شامل میشوند. ترکیب آنها بر اساس سن، رژیم غذایی، جغرافیا و وضعیت سلامت تغییر میکند، اما عملکرد جمعی آنها شگفت انگیزانه ثابت باقی میماند.
نقش های عملکردی
میکروبیوتا مجموعه ای از وظایف حیاتی را بر عهده دارد که برای بقای میزبان و حفظ سلامت او ضروری هستند:
- عملکردهای متابولیک: تخمیر کربوهیدرات های غیرقابل هضم، تولید اسیدهای چرب زنجیره کوتاه (SCFAs)، سنتز ویتامین هایی مانند K2، B12 و فولات
- تنظیم ایمنی: آموزش سلول های ایمنی، تنظیم پاسخ های التهابی، حفظ تحمل مخاطی
- محافظت از سد اپیتلیال: تقویت اتصالات بین سلولی، جلوگیری از کلونیزاسیون پاتوژن ها
- سیگنالدهی عصبی: تعامل با سیستم عصبی روده و تعدیل انتقال دهنده های عصبی مانند GABA و پیش سازهای سروتونین
این نقش ها صرفاً حمایتی نیستند، بلکه بنیادی اند. مدل های حیوانی بدون میکروب (Germ-free) دچار نقص های عمیق در رشد ایمنی، جذب مواد مغذی و تنظیم پاسخ های استرسی هستند؛ موضوعی که اهمیت سیستمیک میکروبیوتا را برجسته میکند.
میکروبیوتا به عنوان یک واسط پویا
میکروبیوتا نه تنها یک جزء مستقل، بلکه یک واسط پویا میان میزبان و محیط بیرونی است. این مجموعه ورودی های غذایی را پردازش میکند، به داروها واکنش نشان میدهد و با استرسورها سازگار میشود. همین قابلیت سازگاری آن را به یک «هدف درمانی» و همچنین یک «ابزار درمانی» در پزشکی مدرن تبدیل کرده است، از پروبیوتیک ها و پری بیوتیک ها گرفته تا پیوند میکروبیوتای مدفوع (FMT).
پیامدهای بالینی
درک میکروبیوتا به عنوان یک اندام عملکردی، رویکرد ما به بیماری را تغییر میدهد. دیس بیوز دیگر یک پیامد جانبی ساده نیست، بلکه یک محرک بالقوه پاتولوژی است. راهبردهای درمانی که به بازگرداندن تعادل میکروبی کمک میکنند میتوانند در حوزه های مختلف سودمند باشند، از جمله:
- اختلالات گوارشی مانند IBD و IBS
- بیماری های متابولیک مانند چاقی و دیابت ( دیابت چیست)
- سندروم های نوروسایکیاتریک مانند افسردگی و اختلالات طیف اوتیسم
- بیماری های ایمنی محور مانند آلرژی ها و خودایمنی
مکانیسم های تأثیر میکروبیوتای روده بر سلامت انسان
برای درک اینکه چرا باکتری های روده نقش های عمیق و گسترده ای در سلامت انسان دارند، باید فراتر از حضور آنها رفته و عملکردشان را بررسی کنیم. این میکروب ها ساکنان منفعل نیستند؛ بلکه از نظر متابولیک فعال، از نظر ایمنی تعاملگر و از نظر عصبی نقش آفرین هستند. تأثیر آنها از مجموعه ای از مکانیسم های شناخته شده ناشی میشود که در سطوح مولکولی، سلولی و سیستمیک عمل میکنند.
۱. دگرگونی متابولیک و سنتز مواد مغذی
میکروب های روده فیبرهای غذایی و نشاسته های مقاوم را تخمیر کرده و آنها را به اسیدهای چرب زنجیره کوتاه (SCFAs) مانند استات، پروپیونات و بوتیرات تبدیل میکنند. این مولکول ها:
- منبع انرژی برای سلول های کولون (Colonocytes) هستند
- متابولیسم گلوکز و لیپیدها را تنظیم میکنند
- التهاب و استرس اکسیداتیو را تعدیل میکنند
علاوه بر این، برخی باکتری ها ویتامین هایی مانند K2، B12، فولات و بیوتین را سنتز میکنند، ریزمغذی هایی که برای انعقاد خون، سنتز DNA و تولید انرژی سلولی حیاتی اند.
۲. تنظیم سیستم ایمنی
میکروبیوتا با گیرنده های تشخیص الگو مانند Toll-like receptors روی سلول های ایمنی تعامل میکنند و هر دو شاخه ایمنی ذاتی و اکتسابی را شکل میدهند. آنها:
- با القای سلول های T تنظیمی (Tregs) تحمل ایمنی ایجاد میکنند
- از طریق افزایش تولید IgA مقاومت مخاطی را تقویت میکنند
- با تنظیم پروفایل سیتوکین ها، التهاب بیش ازحد را مهار میکنند
این آموزش ایمنی از اوایل زندگی آغاز شده و تا بزرگسالی ادامه پیدا میکند؛ فرآیندی که بر حساسیت های آلرژیک، بیماری های خودایمنی و عفونت ها تأثیر میگذارد.
۳. حفظ یکپارچگی سد روده و دفاع در برابر پاتوژن ها
اپیتلیوم روده سدی حیاتی میان محیط بیرونی و محیط داخلی بدن است. میکروبیوتا به حفظ این سد کمک میکند از طریق:
- تحریک سنتز پروتئین های اتصالات بین سلولی (Tight junctions)
- تولید پپتیدهای ضدمیکروبی و باکتریوسین ها
- رقابت با پاتوژن ها برای مواد مغذی و محل اتصال به اپیتلیوم
اختلال در این تعادل (که به «نشت روده» یا Leaky Gut معروف است) میتواند منجر به التهاب سیستمیک و بیماری شود.
۴. تولید انتقال دهنده های عصبی و ارتباط روده–مغز
میکروب های روده از طریق محور روده–مغز بر سیستم عصبی روده ای و عملکرد مغز مرکزی تأثیر میگذارند. آنها:
- پیش سازهای سروتونین، دوپامین و GABA تولید میکنند
- سیگنال دهی عصب واگ را تعدیل میکنند
- بر التهاب عصبی و یکپارچگی سد خونی–مغزی اثر میگذارند
حدود ۹۵ درصد سروتونین بدن در روده تولید میشود و فعالیت میکروبی مستقیماً بر سنتز و آزادسازی آن اثر دارد، موضوعی که سلامت روده را به خلق و خو، شناخت و رفتار پیوند میدهد.
۵. تنظیم اپیژنتیک و هورمونی
متابولیت های میکروبی میتوانند از طریق مکانیسم های اپی ژنتیک مانند تغییرات هیستونی و متیلاسیون DNA، بیان ژن ها را در سلول های میزبان تغییر دهند. آنها همچنین بر موارد زیر اثر میگذارند:
- ترشح هورمون های روده ای مانند GLP-1 و PYY
- تنظیم اشتها
- هماهنگ سازی ریتم شبانه روزی
این اثرات پیامدهای گسترده ای در سلامت متابولیک، خطر چاقی و حتی فرآیند پیری دارند.
پروبیوتیک ها — تعاریف، مکانیسم های سویه محور و کاربردهای بالینی
1.تعریف و طبقه بندی
طبق تعریف مشترک FAO/WHO، پروبیوتیک ها «میکروارگانیسم های زنده ای هستند که در صورت مصرف در مقادیر کافی، یک اثر مفید برای سلامت میزبان ایجاد میکنند.»
این تعریف سه مؤلفهی کلیدی دارد:
- حیات و پایداری — میکروارگانیسم باید در طول تولید، ذخیره سازی و مصرف زنده بماند.
- دوز مؤثر — اثرات بالینی پروبیوتیک ها وابسته به میزان مصرف و کاملاً سویه محور است.
- سند علمی معتبر — هر سویه باید در مطالعات انسانی اثرگذاری مشخصی داشته باشد.
پروبیوتیک ها از طریق منابع مختلفی عرضه میشوند:
- فرآورده های دارویی مانند کپسول ها و ساشه های لیوفیلیزه.
- غذاهای تخمیری و فانکشنال مانند ماست، کفیر و محصولات غنی سازی شده.
- فرآورده های تغذیه پزشکی مانند فرمول های انترال حاوی سویه های اختصاصی.
گروه های میکروبی رایج عبارت اند از:
- Lactobacillus مانند L. rhamnosus و L. acidophilus
- Bifidobacterium مانند B. infantis و B. longum
- Saccharomyces مانند S. boulardii
- سایر گونهها مانند Streptococcus thermophilus و Escherichia coli Nissle 1917
هر جنس و گونه از نظر متابولیسم، پایداری، تعامل ایمنی و اثرات بافتی تفاوت های چشمگیری دارد و نمیتوان نتایج یک سویه را به سایر سویه های همان جنس تعمیم داد.
2. مکانیسم های اقدام سویه محور
اثرات پروبیوتیک ها ماهیتی کاملاً سویه محور دارند. حتی سویه هایی که از یک گونه مشترک هستند، ممکن است عملکردهای ایمونولوژیک یا اپیتلیالی کاملاً متفاوتی نشان دهند. نمونه هایی از سویه های خوب مطالعه شده عبارتاند از:
| سویه | مکانیسم اثر | هدف بافتی/سلولی | اثر بالینی |
| L. rhamnosus GG | تقویت اتصالات بینسلولی؛ مهار چسبندگی پاتوژن ها | اپیتلیوم روده | کاهش اسهال ناشی از آنتی بیوتیک |
| B. infantis 35624 | افزایش IL-10 و فعالیت سلول های Treg | سلولهای ایمنی لامینا پروپریا | بهبود درد و نفخ IBS |
| S. boulardii | خنثیسازی توکسین های باکتریایی؛ مهار مسیر NF-κB | انتروسیتها و ماکروفاژها | پیشگیری از عود عفونت C. difficile |
| E. coli Nissle 1917 | رقابت با پاتوژن ها؛ تحریک تولید دفنسین ها | مخاط روده | حفظ بهبود در کولیت اولسراتیو |
این مکانیسم ها مشابه اقدامات دارویی هدفمند هستند (از جمله تعدیل سیتوکین ها، تقویت سد مخاطی و تعامل با گیرنده های ایمنی) و به همین دلیل، نگاه درمانی نسبت به پروبیوتیک ها را توجیه میکنند.
3. تعامل با میزبان و فارماکودینامیک
پروبیوتیک ها از مسیرهای مختلفی با میزبان تعامل میکنند:
- کلونیزاسیون گذرا: اغلب سویه ها در میکروبیوتای میزبان بهصورت دائمی باقی نمی مانند، اما هنگام عبور از دستگاه گوارش اثرات گسترده ای ایجاد میکنند.
- سیگنال دهی ایمنی مبتنی بر گیرنده ها: تعامل با گیرنده های TLR، سلول های دندریتیک و PRRهای اپیتلیال باعث تغییر مسیرهای التهابی میشود.
- تولید متابولیت های فعال: شامل SCFAها، باکتریوسین ها و پپتیدهای ضدمیکروبی که بر اپیتلیوم و ترکیب میکروبی اثر میگذارند.
- ترمیم سد مخاطی: افزایش تولید موسین ها و پروتئین های اتصالات محکمی باعث تقویت یکپارچگی سد روده میشود.
فارماکودینامیک پروبیوتیک ها تحت تأثیر پایداری سویه، کیفیت فرمولاسیون، وضعیت میکروبیوتای پایهی میزبان و شرایط ایمنی فرد قرار دارد. این عوامل تفاوت observed در پاسخ درمانی بین بیماران را توضیح میدهد.
4. اندیکاسیون های مبتنی بر شواهد
شواهد بالینی قوی از تجویز پروبیوتیک ها در شرایط زیر حمایت میکند:
اندیکاسیون های تثبیت شده
- پیشگیری از اسهال ناشی از آنتی بیوتیک (به ویژه کودکان و سالمندان)
- کاهش نکروز انتروکولیت نکروزان (NEC) در نوزادان نارس
- حفظ بهبودی در پوچیت و کولیت اولسراتیو در برخی بیماران
اندیکاسیون های نوظهور یا در حال تحقیق
- سایکوبیوتیک ها برای اضطراب، افسردگی و اختلالات استرس محور
- سندرم متابولیک و NAFLD از طریق تعدیل اسیدهای صفراوی و تولید SCFA
- پیشگیری از آلرژی در نوزادان شامل درماتیت آتوپیک و حساسیت های غذایی (وابسته به سویه و زمان تجویز)
این حوزه ها به طور مداوم با انجام کارآزمایی های بالینی دقیق تر در حال پیشرفت هستند.
5. محدودیتها و ملاحظات ایمنی
با وجود محبوبیت گسترده، مصرف پروبیوتیک ها باید منطقی و مبتنی بر شواهد باشد:
- عدم شفافیت سویه در بسیاری از محصولات تجاری، پیش بینی اثربخشی را دشوار میکند.
- تنوع شدید مقررات در کشورهای مختلف باعث نابرابری در کیفیت محصولات میشود.
- عوارض نادر اما مهم شامل فنگمی ناشی از S. boulardii یا باکتریمی در بیماران بسیار بدحال، سرطانی یا دارای وسایل تهاجمی.
- تعاملات بالقوه با داروها: ممکن است بر متابولیسم یا جذب برخی داروها اثر بگذارند، هرچند شواهد محدود است.
تصمیم گیری بالینی باید بر اساس عوامل فردی بیمار، کیفیت محصول و شواهد سویه محور باشد؛ مشابه فرآیند انتخاب یک داروی درمانی.
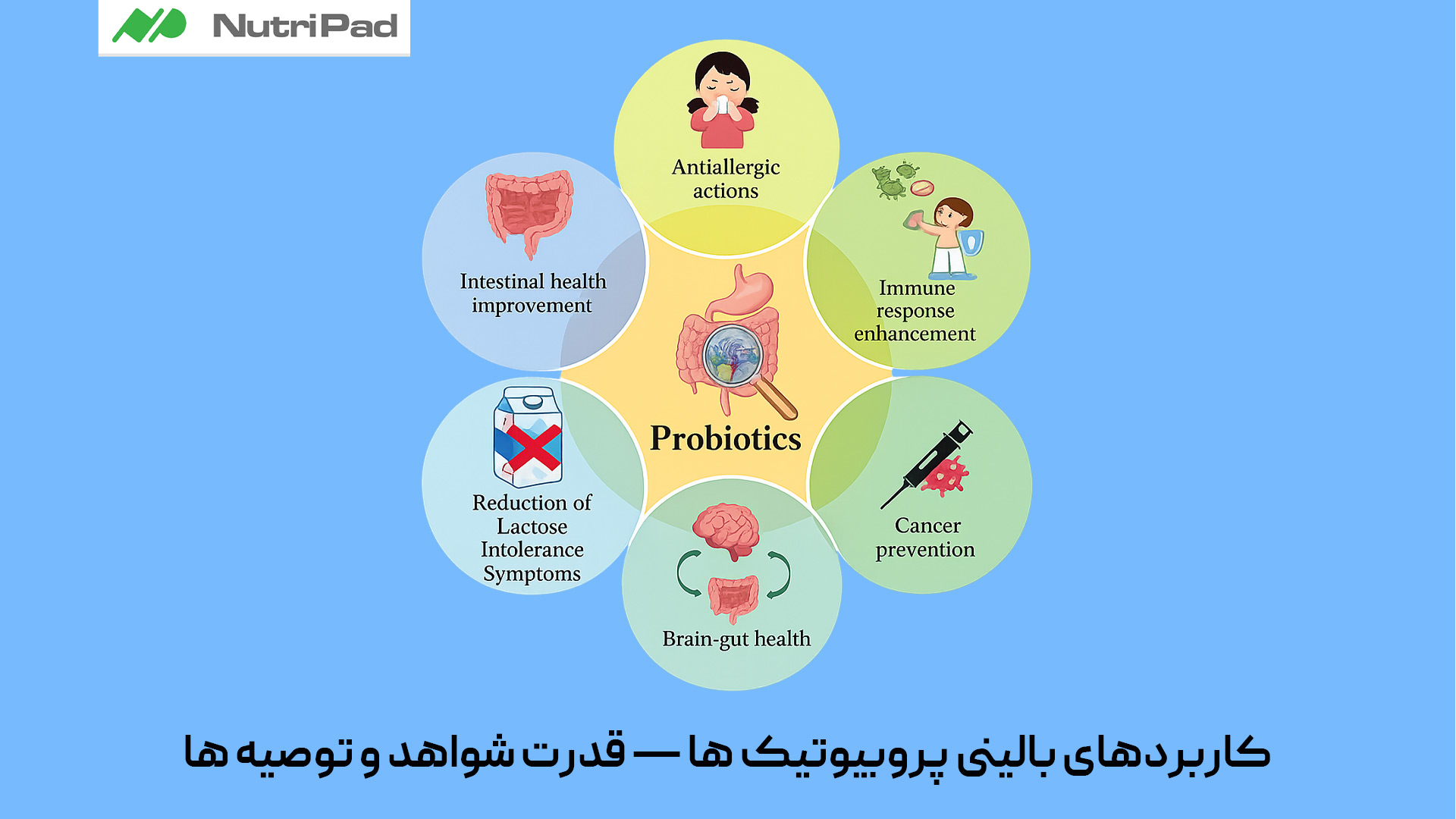
کاربردهای بالینی پروبیوتیک ها — قدرت شواهد و توصیه ها
موارد با شواهد قوی و تأیید بالینی
این شرایط بر اساس کارآزمایی های بالینی تصادفی (RCT)، مرورهای نظام مند و راهنماهای بالینی به طور مداوم حمایت شده اند:
- اسهال ناشی از مصرف آنتی بیوتیک (AAD)
- سویه های توصیه شده: Lactobacillus rhamnosus GG، Saccharomyces boulardii
- شواهد: قوی
- نکته: کاهش بروز و شدت؛ مورد تأیید راهنماهای WGO و AGA
- انتروکولیت نکروزان (NEC) در نوزادان نارس
- • سویه های توصیه شده: ترکیب Bifidobacterium و Lactobacillus
- شواهد: قوی
- نکته: داده های نوزادی قوی؛ توصیه شده در پروتکلهای NICU
- پوچیت (پس از جراحی کولیت اولسراتیو)
- سویههای توصیهشده: فرمولاسیون چندسویه مانند VSL#3
- شواهد: متوسط تا قوی
- نکته: کمک به حفظ بهبودی؛ مورد حمایت راهنماهای گوارش
- پیشگیری از اسهال مسافرتی
- سویه های توصیه شده: S. boulardii، L. acidophilus
- شواهد: متوسط
- نکته: مؤثر در شرایط سفر پرخطر
موارد با شواهد نوظهور یا متوسط
این شرایط امیدبخش هستند اما نیازمند دادههای قویتر و پایدارترند:
- سندرم روده تحریک پذیر (IBS) — برخی سویه ها موجب کاهش نفخ و درد میشوند، به ویژه در IBS با غلبه یبوست.
- درماتیت آتوپیک (نوزادان) — اثر پیشگیرانه در صورت مصرف زودهنگام در زندگی.
- شرایط روان شناختی (سایکوبیوتیک ها) — کارآزمایی های اولیه نشان دهنده بهبود خلق از طریق محور روده–مغز.
- سندرم متابولیک / کبد چرب غیرالکلی (NAFLD) — برخی بهبودها در مقاومت به انسولین و آنزیم های کبدی.
- یبوست مزمن — سویه های خاص موجب بهبود دفعات و قوام مدفوع میشوند.
موارد با شواهد ناکافی یا توصیه منفی
این شرایط فاقد شواهد پایدار هستند یا راهنماها نسبت به مصرف هشدار داده اند:
- عفونت Clostridium difficile (CDI) — شواهد ناکافی؛ AGA توصیه به مصرف تنها در کارآزمایی های بالینی دارد.
- حمایت درمان سرطان — داده های محدود؛ نگرانی های ایمنی در بیماران با نقص ایمنی.
- بیماریهای خودایمنی (مانند RA، MS) — علاقه مکانیکی وجود دارد اما تأیید بالینی نشده است.
- کووید-۱۹ یا عفونت های ویروسی حاد — بدون سود اثبات شده؛ مصرف حدسی و غیرمجاز.
خلاصه سطوح شواهد
- قوی (High): پشتیبانی توسط RCT های متعدد، مرورهای نظام مند و راهنماهای بالینی
- متوسط (Moderate): داده های امیدبخش؛ اثرات سویه محور؛ برخی حمایت راهنماها
- ضعیف (Low): شواهد محدود یا ناسازگار؛ امکان پذیری مکانیکی اما بدون اجماع
- غیرتوصیه شده (Not recommended): فقدان اثربخشی یا نگرانی های ایمنی؛ مصرف منع شده توسط راهنماها
موارد با شواهد قوی (High Evidence)
- اسهال ناشی از آنتی بیوتیک (AAD)
- سویه ها: L. rhamnosus GG، S. boulardii
- توضیح: کاهش بروز و شدت؛ مورد تأیید راهنماهای بین المللی
- انتروکولیت نکروزان (NEC) در نوزادان نارس
- سویه ها: ترکیب Bifidobacterium و Lactobacillus
- توضیح: داده های نوزادی قوی؛ کاهش NEC و مرگومیر
- پوچیت (پس از جراحی کولیت اولسراتیو)
- سویه ها: فرمولاسیون چندسویه مانند VSL#3
- توضیح: کمک به حفظ بهبودی؛ مورد حمایت راهنماهای گوارش
- پیشگیری از اسهال مسافرتی
- سویه ها: S. boulardii، L. acidophilus
- توضیح: مؤثر در شرایط سفر پرخطر
موارد با شواهد متوسط یا نوظهور (Moderate / Emerging Evidence)
- سندرم روده تحریکپذیر (IBS) — برخی سویه ها موجب کاهش نفخ و درد میشوند، به ویژه در IBS با غلبه یبوست.
- درماتیت آتوپیک (نوزادان) — اثر پیشگیرانه در صورت مصرف زودهنگام.
- شرایط روان شناختی (سایکوبیوتیک ها) — کارآزمایی های اولیه نشان دهنده بهبود خلق از طریق محور روده–مغز.
- سندرم متابولیک / کبد چرب غیرالکلی (NAFLD) — برخی بهبودها در مقاومت به انسولین و آنزیم های کبدی.
- یبوست مزمن — سویه های خاص موجب بهبود دفعات و قوام مدفوع میشوند.
موارد با شواهد ناکافی یا توصیه منفی (Insufficient / Not Recommended)
- عفونت Clostridium difficile (CDI) — شواهد ناکافی؛ توصیه به مصرف تنها در کارآزمایی های بالینی.
- حمایت درمان سرطان — داده های محدود؛ نگرانی های ایمنی در بیماران با نقص ایمنی.
- بیماری های خودایمنی (RA، MS) — علاقه مکانیکی وجود دارد اما تأیید بالینی نشده است.
- کووید-۱۹ یا عفونت های ویروسی حاد — بدون سود اثبات شده؛ مصرف حدسی و غیرمجاز.
عوارض جانبی و ملاحظات ایمنی
اگرچه پروبیوتیک ها به طور کلی برای بیشتر افراد سالم ایمن در نظر گرفته میشوند، برخی خطرات و نگرانی های ایمنی وجود دارد که به ویژه در گروه های آسیب پذیر باید مورد توجه قرار گیرند.
خطرات نادر اما مهم
- باکتریمی در بیماران با نقص ایمنی: هرچند بسیار نادر است، مواردی از عفونت خونی ناشی از سویه های پروبیوتیک در افراد با سیستم ایمنی شدیداً تضعیف شده گزارش شده است. این موضوع ضرورت احتیاط در تجویز پروبیوتیک ها برای بیماران تحت شیمی درمانی، پیوند عضو یا مبتلایان به بیماری های مزمن پیشرفته را نشان میدهد.
- ترانسلوکاسیون در بیماران بحرانی: در شرایط خاص، باکتری های پروبیوتیک ممکن است از سد روده عبور کرده و وارد جریان خون یا سایر نواحی استریل بدن شوند. این خطر بیشتر در بیماران بحرانی با آسیب دیدگی جدی دیواره روده، مانند بیماران بستری در بخش مراقبت های ویژه، مطرح است.
مسائل نظارتی و برچسب گذاری
محصولات پروبیوتیک اغلب به عنوان مکمل غذایی و نه داروهای رسمی عرضه میشوند؛ بنابراین نظارت قانونی بر آنها در کشورهای مختلف متفاوت است. مواردی مانند برچسب گذاری نادرست، شناسایی اشتباه سویه ها و تفاوت در شمار کلونی ها گزارش شده اند. این مشکلات انتخاب آگاهانه توسط پزشکان و مصرفکنندگان را دشوار میسازد و اهمیت استانداردسازی کنترل کیفیت را برجسته میکند.
توصیه هایی برای مصرف ایمن
- مصرف پروبیوتیک ها در بیماران با نقص ایمنی یا بیماران بحرانی باید با احتیاط و تحت نظر پزشک انجام شود.
- پزشکان باید محصولاتی را انتخاب کنند که سویه های آنها به طور علمی مستند و ایمنی شان در جمعیت هدف تأیید شده باشد.
- تولیدکنندگان باید به استانداردهای سختگیرانه کیفیت پایبند باشند، از جمله برچسب گذاری دقیق سویه ها و شمار زنده آنها.
- برای جمعیت عمومی، پروبیوتیک ها در دوزهای توصیه شده ایمن هستند؛ با این حال پایش مداوم و نظارت پس از عرضه برای تضمین ایمنی بلندمدت ضروری است.
سناریوهای بالینی و تصمیم گیری
استفاده از پروبیوتیک ها در عمل بالینی نیازمند توجه دقیق به شرایط بیمار، شواهد موجود و ملاحظات ایمنی است. نمونه های موردی زیر نشان میدهند که پزشکان چگونه میتوانند در موقعیت های مختلف تصمیم گیری کنند.
آیا باید پس از مصرف آنتی بیوتیک پروبیوتیک تجویز شود؟
درمان با آنتی بیوتیک اغلب میکروبیوتای روده را مختل میکند و میتواند منجر به عوارضی مانند اسهال ناشی از آنتی بیوتیک (AAD) شود. کارآزمایی های بالینی تصادفی و مرورهای نظام مند متعدد از مصرف سویههای خاص پروبیوتیک (به ویژه Lactobacillus rhamnosus GG و Saccharomyces boulardii) برای کاهش بروز و شدت AAD حمایت میکنند. در بیماران سالم، تجویز پروبیوتیک همراه با آنتی بیوتیک های وسیع الطیف میتواند یک مداخله منطقی و مبتنی بر شواهد باشد. با این حال، پزشکان باید از فرمولاسیون های سویه محور استفاده کنند و در بیماران با نقص ایمنی شدید احتیاط نمایند.
آیا پروبیوتیک ها میتوانند در افسردگی خفیف مؤثر باشند؟
پژوهش های نوظهور در زمینه «سایکوبیوتیک ها» نشان میدهند که برخی سویه های پروبیوتیک ممکن است از طریق محور روده–مغز بر خلق و خو و سلامت روان اثر بگذارند. کارآزمایی های اولیه با سویه هایی مانند Lactobacillus helveticus و Bifidobacterium longum بهبودهای اندکی در علائم افسردگی خفیف و اضطراب نشان داده اند. هرچند این یافته ها امیدبخش هستند، شواهد هنوز مقدماتی و ناهمگون اند. پروبیوتیک ها نباید جایگزین درمان های تثبیت شده افسردگی شوند، اما میتوانند به عنوان درمان کمکی در بیماران منتخب مورد استفاده قرار گیرند، مشروط بر اینکه انتظارات مدیریت شوند و پایش مداوم انجام گیرد.
چه نکاتی باید پیش از توصیه پروبیوتیک در ICU در نظر گرفته شود؟
بیماران بحرانی چالش های ویژه ای برای مصرف پروبیوتیک دارند. اگرچه پروبیوتیک ها برای پیشگیری از عفونت ها و تعدیل میکروبیوتای روده در محیط های مراقبت ویژه مورد مطالعه قرار گرفته اند، نگرانی های ایمنی همچنان مطرح است. خطرات نادر اما جدی شامل ترانسلوکاسیون باکتری ها و عفونت های خونی است، به ویژه در بیمارانی با سد روده آسیب دیده یا نقص ایمنی شدید. ناهماهنگی های نظارتی و کیفیت متغیر محصولات نیز تصمیم گیری را پیچیده تر میکند. در محیط های ICU، پروبیوتیک ها باید تنها در چارچوب کارآزمایی های بالینی طراحی شده یا تحت پروتکل های سختگیرانه بیمارستانی و با ارزیابی دقیق سود–زیان مورد استفاده قرار گیرند.
جمع بندی و نکات عملی
پروبیوتیک ها به عنوان یک مکمل نویدبخش در پزشکی مدرن مطرح هستند؛ با مزایای روشن در برخی شرایط مشخص و ظرفیت های نوظهور در سایر موارد. در عین حال، استفاده از آنها نیازمند توجه دقیق به خطرات، زمینه بالینی بیمار و کیفیت محصول است.
خلاصهای از فواید در برابر خطرات
- فواید: شواهد قوی از مصرف پروبیوتیک ها در اسهال ناشی از آنتی بیوتیک، انتروکولیت نکروزان در نوزادان نارس، پوچیت و پیشگیری از اسهال مسافرتی حمایت میکنند. شواهد متوسط نیز برای شرایطی مانند سندرم روده تحریک پذیر، درماتیت آتوپیک و یبوست مزمن وجود دارد.
- خطرات: هرچند نادر، عوارض جدی مانند باکتریمی یا ترانس لوکاسیون ممکن است در بیماران با نقص ایمنی یا بیماران بحرانی رخ دهد. همچنین ناهماهنگی های نظارتی و مشکلات برچسب گذاری چالشهایی برای مصرف ایمن و مؤثر ایجاد میکنند.
اصول استفاده منطقی
- انتخاب فرمولاسیون های سویه محور که پشتوانه شواهد بالینی دارند.
- پرهیز از مصرف در بیماران با نقص ایمنی شدید یا بیماران بحرانی مگر تحت پروتکل های سختگیرانه.
- اطمینان از برچسبگذاری دقیق، شمار زنده سویه ها و رعایت استانداردهای کیفی.
- استفاده از پروبیوتیک ها بهعنوان درمان کمکی و نه جایگزین درمان های تثبیت شده.
چشم اندازهای آینده
- درمان های شخصی سازی شده میکروبیوم: پیشرفت در توالی یابی و پروفایل سازی میکروبیوم میتواند امکان مداخلات پروبیوتیکی متناسب با ویژگی های فردی را فراهم کند.
- ادغام با پزشکی دقیق: ترکیب پروبیوتیک ها با رژیم غذایی، سبک زندگی و درمان های دارویی میتواند نتایج را بهبود بخشد.
- هماهنگی نظارتی: ارتقای استانداردهای جهانی برای محصولات پروبیوتیک ایمنی و اثربخشی آنها را تقویت خواهد کرد.